光が、エネルギー粒子としての性質(Einstein)と波としての性質(Maxwell)の両方の性質を持つことは広く知られている。光化学の化学量論的な議論では、エネルギー粒子(光子:フォトン)として扱い(1モルの光子=1Einstein)、エネルギー議論では波として扱う。この2つを橋渡しするのが、プランクの法則であり、1光子の持つエネルギー(ε)は以下の式によって得られる。
UV硬化プロセス上で直面する色々な課題とその解決策
その5:UV(紫外線)照射波長について
1. はじめに
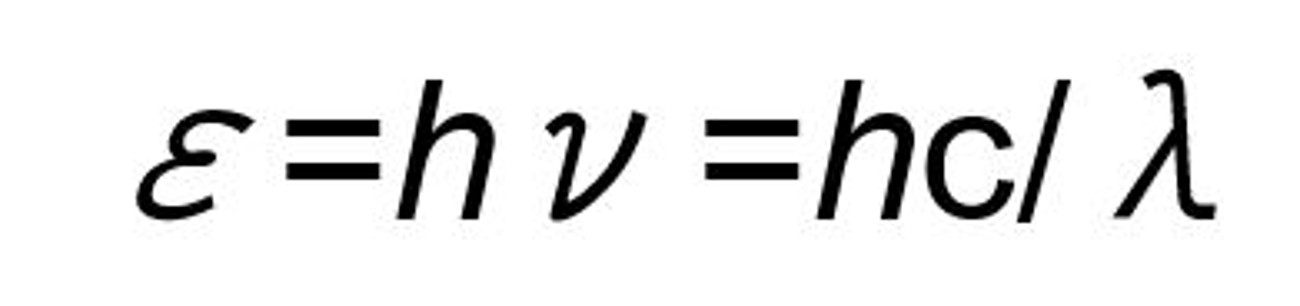
この式において、h:Plank定数(6.6x10-34Js)、ν:光の振動数、c:光速(3.0x108m/s)、λ:波長である。この式より、1アインシュタイン(1モル)の光子のエネルギーは、1.20 x 105/λkJ/molとなる。通常UV硬化プロセスで使用する200~400nmの波長領域の光は、波長によって異なるが1モルあたり300~600kJ/molのエネルギーを有するエネルギー線である。
UV硬化プロセスでは、硬化材料中の特に光重合開始剤の吸収スペクトルとUV照射光源の発光スペクトルとのマッチング(スペクトルの重なり)が重要となる。ただし、照射波長によっては、たとえ開始剤がUVエネルギーを吸収しても電子励起状態が異なってくる場合もあるため、あらかじめ材料の吸収スペクトルを調べておくことは重要な知見をもたらすことが多い。以下に具体的な開始剤の吸収スペクトルを例にとり紹介する。
2. 開始剤の吸収スペクトル
開始剤の吸収スペクトルの代表例として、図1に示すようなベンゾフェノンの吸収スペクトルを紹介する。ベンゾフェノンは、UVを吸収し、励起三重項状態からNorrish Type IIの水素引き抜き反応を引き起こし、ラジカルを生成することはよく知られている。開始剤としてよく使用されるNorrish Type Iの開裂反応を起こしてラジカルを生成する開始剤も、UVエネルギーを吸収し励起状態を形成するプロセスは、ベンゾフェノンとまったく同じである。ベンゾフェノンの吸収スペクトルは、各吸収バンドが波長別にわかりやすく分離しているため代表例として用いた。
吸収スペクトルは、共有結合を有する化合物が光エネルギーを吸収し、その化合物中の電子が非結合性軌道や結合性軌道から反結合性軌道へ遷移する状態を示したものである。この辺りの詳細な記述は省略するが、化合物が共有結合を形成すると、原子を結合させようとする原子核間に高い電子存在確率を有する結合軌道(σ軌道とπ軌道)と、それとは逆に原子を引き離そうとする原子核間に電子の存在確率がゼロになる反結合軌道(σ*軌道とπ*軌道)が形成される。また、化合物の中には、ヘテロ原子に密着した分子の結合系に含まれない非結合性軌道(n軌道)に電子を有するものもある(ローン・ペア)。


図1に示した縦軸(ε)は、分子吸光係数と呼ばれるもので、各分子に固有で波長により異なる光の吸いやすさの物差しとなる係数である。
ベンゾフェノンの吸収スペクトルをみると390nmあたりから、300nmあたりにかけて、弱い吸収帯が観測される(通常ε<1,000、ベンゾフェノンのε(max)は、200~300程度)。これは、ベンゾフェノンのカルボニル酸素のローン・ペアの一つの電子がπ*軌道に遷移する、いわゆるn→π*の遷移に基づくものである。図2のn→π*のエネルギー準位(図2におけるエネルギー・ギャップ)は、吸収スペクトルの最大ピーク波長(極性溶媒中:340nm、非極性溶媒中:350nm)に相当するエネルギーとなる。
図1のスペクトルでは、280nm付近に第2の吸収帯、そして250nm付近(非極性溶媒中、極性溶媒中では、260nm付近)に第3の吸収ピークが観測される。これらの吸収は、第一のn→π*の吸収に比べはるかに強い(ε>1,000)。この分子吸光係数の大小が、それぞれの吸収帯が、n→π*もしくはπ→π*のどちらの遷移に基づくものかを見極めるひとつの指標となる。
この第2の吸収帯は、ベンゾフェノンのカルボニル基の二重結合を形成するπ電子のπ*軌道への遷移(π→π*)に基づくものである。そして、250nm付近の最も強い吸収帯は、ベンゾフェノンの芳香環のπ→π*遷移によるものである。π→π*遷移のほうがn→π*遷移に比べエネルギー・ギャップが大きいため、通常π→π*遷移に基づく吸収は、n→π*遷移よりも短波長側に現れる。
開始剤にUVを照射し開始活性種を生成するプロセスでは、開始剤のカルボニル基を励起することが必須の条件となる。250nm付近の吸収帯にUVを照射するとベンゾフェノンの芳香環は励起されるが、励起された芳香環π電子は熱的に失活して基底状態に戻るため開始活性種の生成は起こらない。従って、ベンゾフェノンのカルボニル基を励起するためには、300~390nmの波長の光もしくは280nm付近の波長の光を照射する必要がある。

次にベンゾフェノンを280nm付近の波長と340nm付近の波長で照射した場合の差異について述べる。図3にベンゾフェノンカルボニル基のエネルギーダイアグラムを示した。カルボニル基が280nmの光を照射されるとカルボニルπ電子は、π*状態に励起されるが、この励起一重項状態は最低エネルギー準位のS1よりさらに高いS2状態であり、このS2状態は非常に速い速度で内部変換によりS1状態となる。そして、最終的な電子励起状態は、340nmで照射した状態と同じ状態を形成し、開始活性種を生成する。ただし、π→π*では、先に述べた分子吸光係数が、n→π*に比べ格段に大きく、より多くの光が表面で吸収されることになり、内部を硬化する目的や開始活性種濃度を高める(重合開始点を増やす)目的には適しているとは言い難い(この件に関しては、後述する)。従って、通常のUV硬化プロセスにおける照射波長は、フェニルケトン系の開始剤の場合はn→π*の吸収帯をターゲットとして設定するのが一般的である。
3. 吸収スペクトルのスペクトルシフト
図1に示したベンゾフェノンの吸収スペクトルにも示されるように、フェニルケトン系の開始剤の吸収スペクトルは、媒体の極性によりスペクトルシフトを起こす。このスペクトルシフトの状態が、分子吸光係数(ε)の大小(n→π*:ε<1,000、π→π*:ε>1,000)とは別に、遷移がn→π*であるか、π→π*であるかを見分ける目安となっている。すなわち、図1に示すように、n→π*遷移では、吸収スペクトルが非極性媒体中では長波長シフトし(レッドシフト:安定化)、極性媒体中では短波長シフト(ブルーシフト:不安定化)する。一方、π→π*遷移では、n→π*遷移とは全く反対の挙動を示し、非極性媒体中では短波長シフト、極性媒体中では長波長シフトを示す。このことから、特にn→π*が極性媒体中で吸収帯がブルーシフトするため、極性媒体での組成配合を検討する場合は、光源の発光スペクトルと吸収スペクトルとのスペクトルマッチングに注意が必要な場合がある。

このようなスペクトルシフトは、フェニルケトン系の化合物のカルボニル基の電子状態に起因して起こる。カルボニル基の酸素上の非結合性軌道(n軌道)には1対の電子(ローンペア)があり、カルボニル基の二重結合を形成している結合性π軌道にも1対の電子がある。そしてフェニルケトンのカルボニル上のπ軌道はフェニル環π軌道と共役している状態である。図4にエネルギーダイアグラムの模式図を示したが、基底状態のカルボニル基の電子は酸素側に大きく分極しているので、極性溶媒中では安定化される。特に、プロトン性極性溶媒中では、水素結合の効果により大きく安定化される。
n→π*の遷移状態では、π*軌道は主に炭素側に広く分布し、酸素上のn電子が1つになるため基底状態に比べ分極が弱まり、極性溶媒による安定化の度合いは基底状態より低くなる。このため極性溶媒中のn→π*の遷移によるS0→S1のエネルギー・ギャップが非極性溶媒に比べ大きくなるため、n→π*の遷移の基づく極性溶媒中の吸収スペクトルは、非極性溶媒中のものと比べ短波長側にシフトする。
一方、π→π*遷移状態では、π*軌道はベンゾフェノンの炭素側分子全体に広がって分布しているため、カルボニル酸素上のn電子は基底状態に比べ、より大きく分極している。その結果、π→π*遷移状態の分子は、極性溶媒中でより大きく安定化されるため、S0→S2のエネルギー・ギャップが非極性溶媒に比べ小さくなり、π→π*の遷移に基づく極性溶媒中の吸収スペクトルは、非極性溶媒中のものと比べ長波長側にシフトする。
4. 光重合開始剤の適正な濃度の設定
UV硬化材料の設計において、光重合開始剤の選定と濃度の設定は、重要な課題である。UV硬化プロセスにおいて光化学的プロセスにより開始活性種を生成する役割を担う光重合開始剤の選定と濃度の設定は、硬化性や硬化物特性に直接影響をあたえる重要な因子である。開始剤の種類の選定は、UV照射光源の発光スペクトルとのマッチングや樹脂媒体への溶解性等で決定される。また、開始剤の適正濃度の設定は、実験的に濃度効果を検討し、目的とする硬化物特性を発現するのに最適な条件を見出して設定するのが現実的に行われている重要な手法である。ここでは、材料への照射波長が明確になっている場合、Lambert-Beerの法則を用いて、あらかじめ計算によりおおよその開始剤の適正濃度を設定する方法を紹介する。Lambert-Beerの法則については、教科書にも必ず出てくる法則であるので詳細な説明は控えるが、単一波長の平行光が光透過性均一物質に吸収される場合に、「透明な媒体に吸収される光量は照射光の強度に無関係であり、媒体の連続した各層は入射光の等しい量を吸収する」(Lambertの法則)と「物質に吸収される光量は光を吸収する分子の数に比例する」(Beerの法則)を合わせたものであり、吸光度(Abs)は次のような式で与えられる。
Abs = log(I0/It) = εcd
ここでI0:入射光量、It:透過光量、ε:分子吸光係数、c:モル濃度、d:厚み(光路長)である。Lambert-Beerの法則を用いて、図5に示すような、ある任意の厚み(d)のある開始剤を含む材料(開始剤の濃度は、ある波長における吸光度が、0から2.0まで変化している。すなわち入射した光が材料全体で0%から99%吸収している状態を想定している。)にI0の光が入射した場合に、表層の1%と底部の1%の厚みの部分の開始剤が入射した光の何%の光を吸収するかを計算より求めた。計算結果を材料全体の開始剤の吸光度(濃度に対応)に対してプロットしたものを図5に示した。
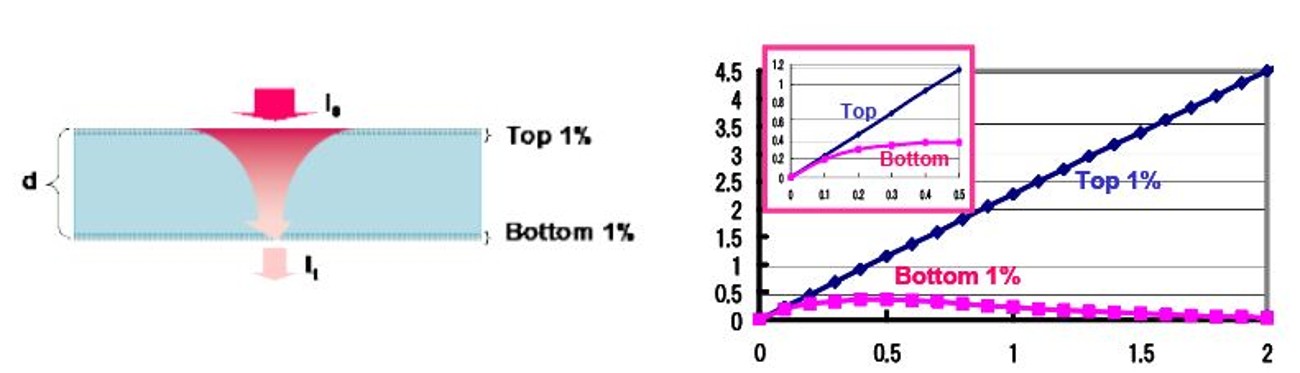
図5より、材料全体のある波長における開始剤の吸光度が0から2.0変化する(すなわち、透過率が100%から1%に変化する)とき、この材料の表層の1%が入射光に対して吸収する割合は、吸光度が増すにつれ直線的に増加し、表面での吸収が増加することがわかる。すなわち、当然の現象であるが、開始剤の濃度が上昇すればするほど、表層でのUV吸収の割合が増加する。一方、興味深いことに、下層の1%のUVの吸収率は、ある吸光度で極大値を示していることがわかる。通常のUV硬化プロセスでは、UV照射は一方向からのみ行われるため、特殊な用途を除いて表層と下層の架橋密度を一定にすることが好ましい。そのためには、表層と下層において生成する開始活性種の量を同程度に調整する必要がある。表層の酸素による硬化阻害の影響等、UV照射の環境的な条件も考慮する必要があるが、少なくともある波長の開始剤の全体の吸光度が0.4(正確には0.43)以下で図5中のTopとBottomの1%の厚さの領域のUV吸収率のギャップが可能な限り少ない吸光度になるように開始剤濃度を設定することが必要である。
図6に代表的な開始剤と一例として365nmにおけるそれぞれの開始剤の分子吸光係数(ε)を示した。

この表から、例えば1mm厚の硬化材料の365nmにおける吸光度(Abs)が0.5になるように開始剤の濃度調整を行うと、Beerの法則(Abs = εd[PhI])から、例えば184であると約350mM、651であると約50mM程度の濃度となる。もちろんこの2種類の開始剤のラジカル生成の機構や量子収率(1フォトンの吸収に対してのラジカル生成効率)は異なるが、少なくともこれらに差がないと仮定すると、184を使用することにより651に比べ約7倍(ITXに対しては約350倍)の重合開始点を生成することが可能であることを示唆している。このことから、光重合開始剤の選定に際しては、開始剤の硬化樹脂系への溶解性だけでなく、ターゲットとする照射波長における分子吸光係数も考慮することが重要である。
以上、UV照射波長について述べたが、UV硬化材料の開発やUV硬化プロセスの構築に際しては、使用する開始剤もしくは材料のUV吸収挙動を把握することにより、適正な濃度設定や適切な光源選定などに関する重要な知見を得ることも多い。






